A hold-and-feed mechanism drives directional DNA loop extrusion by condensin
Science 3 June 2022
10.1126/science.abm4012
Researchers have uncovered the inner workings of the molecular machinery that shapes chromosomes during cell division
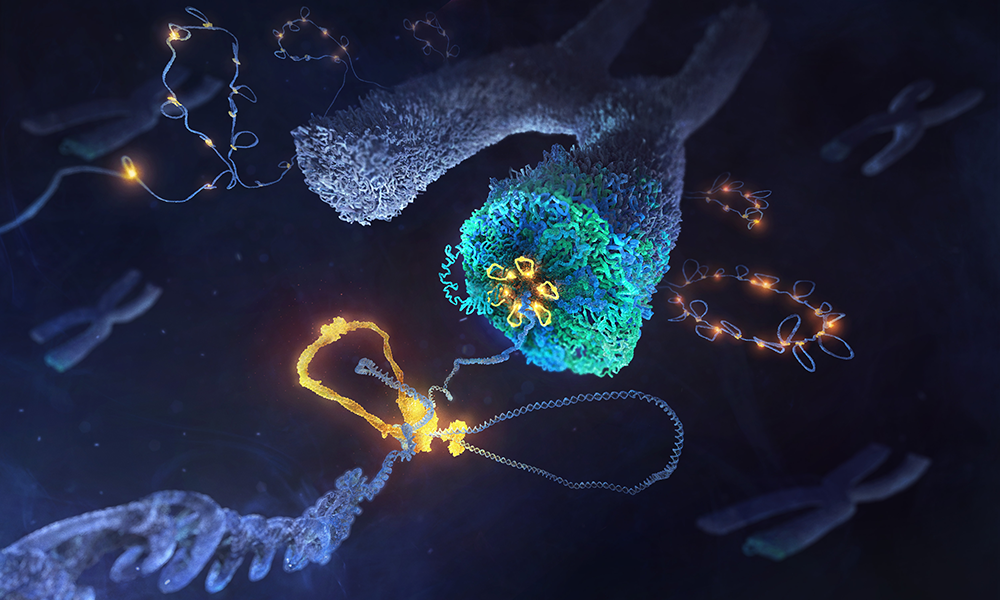
Our cells perform a marvel of engineering when it comes to packing information into small spaces. Every time a cell divides, it bundles up an amazing 4 metres of DNA into 46 tiny packages, each of which is only several millionths of a metre in length. Researchers from EMBL Heidelberg and the Julius-Maximilians-Universität Würzburg have now discovered how a family of DNA motor proteins succeeds in packaging loosely arranged strands of DNA into compact individual chromosomes during cell division.
The researchers studied condensin, a protein complex critical to the process of chromosome formation. Although this complex was discovered more than three decades ago, its mode of action remained largely unexplored. In 2018, researchers from the Häring group at EMBL Heidelberg and their collaborators showed that condensin molecules create loops of DNA, which may explain how chromosomes are formed. However, the inner workings by which the protein complex achieves this feat remained unknown.
“We have been working on this problem for a long time. But only now, by combining different experimental approaches, we have found an answer to this long-standing question,” said Christian Häring, former Group Leader at EMBL Heidelberg and now Professor at the Julius-Maximilians-Universität Würzburg.
Through meticulously designed experiments, some of which involved observing and manipulating single condensin molecules while they were in the process of forming DNA loops, the researchers found how different parts of the complex collectively act as a molecular machine: one part holds the DNA steady, like an anchor, whereas the other acts as a motor which moves the DNA forward, thus creating a wide loop.
Like other motor proteins, condensin takes ‘steps’ along the DNA, burning cellular energy in the form of ATP while doing so. However, these steps are more than 500 times longer than the steps taken by other DNA motor proteins, even though the amount of energy used is roughly the same. “It’s like a formula one racing car with the energy efficiency of an e-bike,” said Indra Shaltiel, the first author.
“Advancements in cryo-electron microscopy techniques allowed us to visualise this complex mechanism in unprecedented detail,” said Sebastian Eustermann, Group Leader at EMBL Heidelberg and a senior author of the study published in Science. “We could capture condensin in action and derived a molecular choreography of how ATP fuels its motor activity – a key step towards understanding DNA loop formation. Similar loops and related molecular machines have been implicated in diverse genomic processes, including the control of how genes are switched on and off in between cell divisions. Consequently, our findings may have even wider implications.”
Condensins belong to one of the most evolutionarily ancient families of chromosomal proteins. The discovery of this new mechanism thus opens up a whole new field of study. “Members of the class of motor proteins condensin belongs to are presumably essential for all life on earth,” Häring said. “It is obvious we are only just starting to understand their roles and how they might be affected in human conditions.”
Die Zellen des Menschen vollbringen eine technische Höchstleistung, wenn es darum geht, Informationen auf kleinstem Raum unterzubringen. Jedes Mal, wenn sich eine Zelle teilt, bündelt sie die vier Meter lange DNA in 46 winzige Pakete, von denen jedes nur einige Millionstel Meter lang ist.
Forschungsgruppen des Europäischen Laboratoriums für Molekularbiologie EMBL Heidelberg und der Julius-Maximilians-Universität Würzburg (JMU) haben nun herausgefunden, wie es einer Familie von DNA-Motorproteinen gelingt, bei der Zellteilung lose angeordnete DNA-Stränge zu kompakten einzelnen Chromosomen zu verpacken.
Die Forschenden untersuchten den Proteinkomplex Condensin, der für die Chromosomenbildung entscheidend ist. Obwohl dieser Komplex bereits vor mehr als drei Jahrzehnten entdeckt wurde, blieb seine Wirkungsweise lange Zeit unerforscht. Erst im Jahr 2018 zeigten Christian Häring und sein Team am EMBL Heidelberg, dass Condensin-Moleküle DNA-Schleifen formen – das war eine mögliche Erklärung für die Bildung der Chromosomen. Der Mechanismus, mit dem der Proteinkomplex dieses Kunststück vollbringt, blieb jedoch weiterhin unbekannt.
„Wir arbeiten schon seit langem an diesem Problem. Aber erst jetzt, durch die Kombination verschiedener experimenteller Ansätze, haben wir eine Antwort gefunden“, sagt Häring. Der ehemalige Gruppenleiter am EMBL Heidelberg ist inzwischen Professor am Biozentrum der JMU. Hier leitet er den Lehrstuhl für Biochemie und Zellbiologie.
Das Team hatte Erfolg mit sorgfältig konzipierten Experimenten. Dabei wurden auch einzelne Condensin-Moleküle beobachtet und manipuliert, während sie DNA-Schleifen formten. So kam heraus, wie verschiedene Teile des Komplexes gemeinsam als molekulare Maschine wirken: Ein Teil hält die DNA wie ein Anker fest, während der andere als Motor fungiert, der die DNA vorwärts bewegt und so eine lange Schleife erzeugt.
Wie andere Motorproteine bewegt sich Condensin in „Schritten“ entlang der DNA und verbrennt dabei zelluläre Energie in Form von ATP. Allerdings sind diese Schritte mehr als 500 Mal länger als die anderer DNA-Motorproteine, obwohl der Energieaufwand in etwa derselbe ist. „Das ist wie ein Formel-1-Rennwagen mit der Energieeffizienz eines E-Bikes“, sagt Indra Shaltiel. Der JMU-Forscher ist der Erstautor der Studie, die jetzt im Journal Science publiziert wurde.
„Dank der Fortschritte in der Kryo-Elektronenmikroskopie konnten wir diesen komplexen Mechanismus in noch nie dagewesener Genauigkeit sichtbar machen“, sagt Seniorautor Sebastian Eustermann, Gruppenleiter am EMBL Heidelberg.
„Wir konnten Condensin in Aktion sehen und die molekulare Choreografie erkennen, mit der ATP seine Motoraktivität antreibt – ein wichtiger Schritt zum Verständnis der DNA-Schleifenbildung. Ähnliche Schleifen und verwandte molekulare Maschinen wurden in verschiedenen genomischen Prozessen nachgewiesen, unter anderem bei der Steuerung des Ein- und Ausschaltens von Genen zwischen Zellteilungen. Daher könnten unsere Ergebnisse noch weitreichendere Auswirkungen haben.“
Condensine gehören zu einer der evolutionär ältesten Familien von Chromosomenproteinen. Die Entdeckung dieses neuen Mechanismus eröffnet ein völlig neues Forschungsgebiet.
„Die Mitglieder der Motorprotein-Klasse, zu der Condensin gehört, sind vermutlich essenziell für alles Leben auf der Erde“, so Häring. „Es ist offensichtlich, dass wir gerade erst anfangen zu verstehen, welche Rolle sie spielen und wie sie in den Zellen des Menschen beeinflusst werden könnten.“
Translation provided by Julius-Maximilians-Universität of Würzburg.
Science 3 June 2022
10.1126/science.abm4012
Looking for past print editions of EMBLetc.? Browse our archive, going back 20 years.
EMBLetc. archive