Read the latest Issue
Toxin responsible for Legionella growth identified
A team of scientists led by EMBL group leader Sagar Bhogaraju and Ivan Dikic of Goethe University, Frankfurt, discovered that the toxin SidJ in Legionella bacteria enforces a unique modification on human proteins and helps legionella grow inside human cells. SidJ hijacks human protein Calmodulin to its own advantage in one of the classic examples of pathogenic bacteria exploiting the human molecular machinery and turning it against us. This makes SidJ an ideal target to curb Legionella infection. The results have been published in Nature.

Legionella – a complex bacterium
Pneumonia resulting from exposure to Legionella – although uncommon and affecting only 1 in 100,000 in Europe – has a higher than 10% fatality rate. The pathogenic bacterium Legionella pneumophila has more than 300 toxins that it uses to infect humans. Once the aerosols containing the bacteria are inhaled, Legionella enters the lungs where it starts infecting human cells, causing pneumonia.
Legionella toxins especially target the innate immune pathways facilitating the survival of the bacteria inside human cells and allowing the replication of the bacteria. Due to the large number of toxins it is difficult to see the effects of deleting one or multiple of these toxins on the Legionella infection capacities. This is further complicated by the fact that several toxins with similar functions exist inside the bacteria. This makes Legionella hard to target with specific drugs.
Focus on the SidJ toxin
Researchers from EMBL Grenoble and the Goethe University in Frankfurt have now studied the toxin SidJ in detail. It is an important toxic protein of Legionella that gets injected into the human cytoplasm and enables the successful infection and replication of the bacteria. In contrast to the other toxins in Legionella, the deletion of SidJ alone leads to a considerable growth defect of the bacteria in human cells. This makes SidJ one of the most important toxins of Legionella and an attractive target to curb Legionella infection.
While SidJ has been studied in the field for already more than a decade, the precise function of it remained unknown until today. “SidJ has no sequence similarity to any of the proteins with a known function. We had to resort to standard biochemical methods and mass spectrometry to determine its function”, explains Bhogaraju. “While working out its mechanism proved to be challenging, it was also very exciting!”
In particular, the missing detailed molecular study of the toxin hindered the development of drugs that can target SidJ. The work by multidisciplinary scientists of Bhogaraju and Dikic groups now describes the molecular function of this protein in detail, elucidates its importance for Legionella infection and provides the identity of the human proteins that are targeted by SidJ.
Toxin at work
The group showed that SidJ possesses protein glutamylation activity: it attaches the amino acid glutamate to a target protein as post-translational modification. “This kind of activity is a first for bacterial proteins”, says Ivan Dikic, Director of the Institute of Biochemistry II at Goethe University. SidJ glutamylates many human proteins that are involved in tackling microbial infections and innate immunity. In order to do this, SidJ interacts with the human protein Calmodulin – a highly conserved multifunctional intermediate calcium-binding messenger protein. “Legionella has cleverly evolved to use Calmodulin to trigger SidJ’s activity and as a result prevents SidJ’s activation before the infection in the human body takes place”, says Dikic.
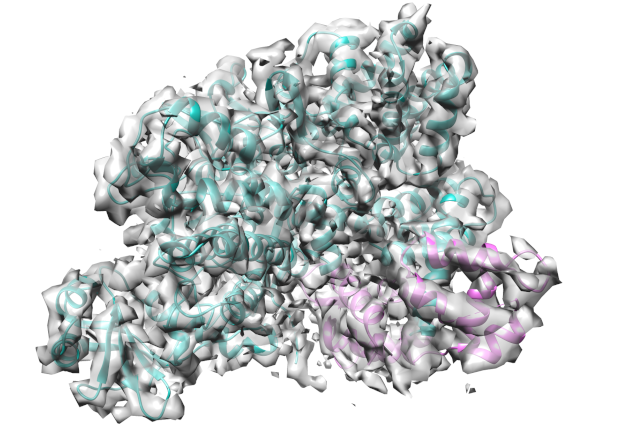
The cryogenic electron microscopy structure of SidJ interacting with human Calmodulin also revealed that the toxin has a kinase domain fold. “This is a both interesting and important find, as the kinase fold is druggable” says Michael Adams, a PhD student in Bhogaraju group.
A recently study published study in Science by Miles Black et al. reached similar conclusions regarding the function of SidJ
Start of a long way to therapeutic usage
The outcome of the study is going to prime many studies in the future, further dissecting the mechanism of SidJ mediated glutamylation. Importantly, since the researchers found that SidJ has a kinase fold, this discovery will initiate the search for a drug molecule with potential therapeutic effects.
“While our work doesn’t have a direct pharmaceutical application, our results on the structural and functional characteristics of one of the most important toxins of Legionella, will lead to future studies aiming to target this protein for therapeutic uses”, says Sagar Bhogaraju.
Toxine responsable de la croissance de Legionella identifiée
Une équipe de scientifiques dirigée par Sagar Bhogaraju, chef du groupe EMBL, et Ivan Dikic, de l’Université Goethe de Francfort, a découvert que la toxine SidJ dans la bactérie Legionella entraîne une modification unique des protéines humaines et favorise la croissance des légionelles dans les cellules humaines. SidJ détourne la protéine humaine Calmodulin à son propre avantage dans l’un des exemples classiques de bactéries pathogènes exploitant la machinerie moléculaire humaine et la retournant contre nous. Cela fait de SidJ une cible idéale pour freiner l’infection aux légionelles. Les résultats ont été publiés dans Nature.

IMAGE : EMBL
Legionella – une bactérie complexe
La pneumonie résultant d’une exposition à la Legionella – bien qu’elle soit rare et ne touche qu’une personne sur 100 000 en Europe – a un taux de mortalité supérieur à 10%. La bactérie pathogène Legionella pneumophila possède plus de 300 toxines qu’elle utilise pour infecter les humains. Une fois que les aérosols contenant la bactérie sont inhalés, la Legionella pénètre dans les poumons où elle commence à infecter les cellules humaines, provoquant une pneumonie.
Les toxines de Legionella ciblent particulièrement les voies immunitaires innées facilitant la survie de la bactérie à l’intérieur des cellules humaines et permettant la réplication de la bactérie. En raison du grand nombre de toxines, il est difficile de voir les effets de la suppression d’une ou de plusieurs de ces toxines sur les capacités d’infection à la Legionella. Ceci est encore compliqué par le fait que plusieurs toxines ayant des fonctions similaires existent à l’intérieur de la bactérie. C’est pourquoi il est difficile de cibler la Legionella avec des médicaments spécifiques.
Zoom sur la toxine SidJ
Des chercheurs de l’EMBL Grenoble et de l’Université Goethe de Francfort ont maintenant étudié en détail la toxine SidJ. C’est une protéine toxique importante de la Legionella qui est injectée dans le cytoplasme humain et qui permet l’infection et la réplication des bactéries. Contrairement aux autres toxines de Legionella, la suppression de SidJ seule entraîne un défaut de croissance considérable de la bactérie dans les cellules humaines. Cela fait de la SidJ l’une des toxines les plus importantes de Legionella et une cible attrayante pour freiner l’infection à la Legionella.
Bien que SidJ soit étudié sur le terrain depuis déjà plus d’une décennie, sa fonction précise est restée inconnue jusqu’à aujourd’hui. “SidJ n’a aucune similitude de séquence avec les protéines ayant une fonction connue. Nous avons dû recourir à des méthodes biochimiques standard et à la spectrométrie de masse pour déterminer sa fonction “, explique Bhogaraju. “Si travailler sur son mécanisme s’est avéré être un défi, c’était aussi très excitant !”
En particulier, l’absence d’étude moléculaire détaillée de la toxine a entravé le développement de médicaments pouvant cibler la SidJ. Les travaux de scientifiques multidisciplinaires des groupes Bhogaraju et Dikic décrivent maintenant en détail la fonction moléculaire de cette protéine, élucident son importance pour l’infection à Legionella et fournissent l’identité des protéines humaines qui sont ciblées par la SidJ.
Toxine au travail
Le groupe a montré que la SidJ possède une activité de glutamylation des protéines : elle attache le glutamate d’acide aminé à une protéine cible comme modification post-traductionnelle. “Ce type d’activité est une première pour les protéines bactériennes “, déclare Ivan Dikic, directeur de l’Institut de biochimie II de l’Université Goethe. La SidJ glutamylate de nombreuses protéines humaines impliquées dans la lutte contre les infections microbiennes et l’immunité innée. Pour ce faire, la SidJ interagit avec la protéine humaine Calmodulin – une protéine messagère intermédiaire multifonctionnelle de liaison au calcium hautement conservée. “La Legionella a intelligemment évolué pour utiliser la Calmoduline pour déclencher l’activité de SidJ et, par conséquent, empêcher l’activation de SidJ avant que l’infection dans le corps humain n’ait lieu”, dit Dikic.
La structure de microscopie électronique cryogénique de SidJ interagissant avec la calmoduline humaine a également révélé que la toxine a un pli de domaine kinase. “C’est une découverte à la fois intéressante et importante, car le pli kinase est droguable “, dit Michael Adams, un étudiant en doctorat du groupe Bhogaraju.
Début d’un long chemin vers l’utilisation thérapeutique
Les résultats de l’étude vont amorcer de nombreuses études à l’avenir, disséquant davantage le mécanisme de la glutamylation à médiation de SidJ. Fait important, puisque les chercheurs ont découvert que la SidJ a un pli kinase, cette découverte amorcera la recherche d’une molécule médicamenteuse ayant des effets thérapeutiques potentiels.
“Bien que nos travaux n’aient pas d’application pharmaceutique directe, nos résultats sur les caractéristiques structurelles et fonctionnelles d’une des toxines les plus importantes de Legionella, conduiront à des études futures visant à cibler cette protéine à des fins thérapeutiques”, déclare Sagar Bhogaraju.