Read the latest Issue
Paving the way for new flu drugs
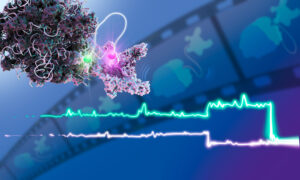
Snapshots of the flu virus replication machine in action
Researchers from EMBL Grenoble have, for the first time, observed different functional states of the influenza virus polymerase as it is actively transcribing. These results, published in Nature Structural & Molecular Biology, provide valuable information for the next generation of anti-influenza drugs.
When a virus infects and enters a host cell, the genomic material in the virus is both replicated to produce multiple copies of itself and transcribed into viral messenger RNA (mRNA). The viral mRNA can be read by the host cell’s protein production machinery, tricking it into making viral proteins. The viral proteins package the copies of the viral genome to make progeny viruses that are released from the cell to infect new hosts. An enzyme called a polymerase is responsible for both the transcription and replication of the viral genome and is therefore crucial to the successful propagation of the virus. The influenza virus, with genomic material made of RNA rather than DNA, is no exception to this modus operandi.
“Studying and understanding the unique mechanisms of transcription and replication used by influenza virus is essential to fight its spread,” explains EMBL group leader Stephen Cusack.
A decade long study
Stephen Cusack and his research group at EMBL Grenoble started to work on influenza polymerase more than 20 years ago. In 2014, the group published the first crystal structures of the complete polymerase machine. However, attempts to structurally characterise the different states of actively transcribing influenza polymerase have so far been unsuccessful.
“All studies so far have looked at the resting structure of the polymerase machine; we’ve never observed it actually doing anything,” says Tomas Kouba, a postdoc in the group who, together with Petra Drncová, carried out much of the work.
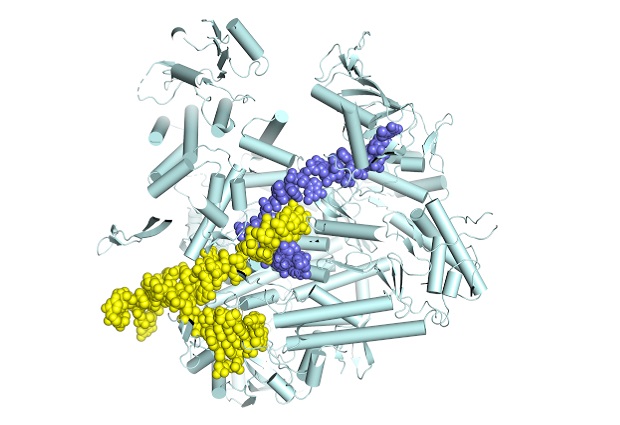
Using X-ray crystallography and cryo-electron microscopy, both performed on state-of-the-art equipment at the European Synchrotron Radiation Facility in Grenoble, the group were able to determine, for the first time, atomic-resolution structures of different functional states of the influenza polymerase as it is actively transcribing genomic RNA into mRNA. In particular, it provides the first characterisation of the movements of the polymerase during the so-called nucleotide addition cycle, whereby each successive nucleotide is added to the growing mRNA chain.
Target point for new drugs
Despite its familiarity, the influenza virus – some strains of which are among the top ten most dangerous viruses in the world – is far from being well understood. Up to 500,000 people worldwide die from influenza each year, according to the World Health Organization, with potentially much higher mortality rates when a new pandemic flu strain emerges. Vaccination is not always effective and anti-influenza drugs are needed as a complementary treatment option.
As the viral polymerase is essential for the replication of the flu virus, it is a prime target for the development of new anti-influenza drugs. As such, the results gained by the EMBL group give new insights to help design the next generation of anti-influenza drugs. The advantage of drugs that stop the polymerase functioning is that it is much less likely that the virus will mutate in a way that would render the drug useless.
“Our results contribute the first snapshots of a movie that will show the complete transcription cycle of influenza polymerase from initiation to termination,” explains Cusack. The group will continue to use the powerful technique of cryo-electron microscopy to fill in the missing steps.
Des images instantanées du mécanisme de réplication du virus de la grippe en action ouvrent la voie à de nouveaux traitements
Les chercheurs de l’EMBL Grenoble ont, pour la première fois, observé différents états fonctionnels de la polymérase du virus influenza en cours de transcription active. Ces résultats, publiés dans Nature Structural & Molecular Biology, fournissent des informations précieuses pour la prochaine génération de traitements contre la grippe.
Lorsqu’un virus infecte et pénètre dans une cellule hôte, le matériel génomique du virus est à la fois reproduit en de multiples copies de lui-même et transcrit en ARN messager viral (ARNm). L’ARNm viral peut être lu par les mécanismes de production de protéines de l’hôte, ce qui les incite à fabriquer des protéines virales. Les protéines virales conditionnent les copies du génome pour en faire des virus descendants qui sont libérés de la cellule pour infecter de nouveaux hôtes. Une enzyme mécanique appelée polymérase est responsable à la fois de la transcription et de la réplication du génome viral et est donc essentielle à la propagation du virus. Le virus de la grippe, dont le matériel génomique est constitué d’ARN plutôt que d’ADN, ne fait pas exception à ce mode de fonctionnement.
« Il est essentiel d’étudier et de comprendre les mécanismes uniques de transcription et de réplication utilisés par le virus de la grippe pour lutter contre sa propagation », explique Stephen Cusack, responsable de l’équipe.
Une étude réalisée sur dix ans
Stephen Cusack et son équipe de l’EMBL Grenoble ont commencé à travailler sur la polymérase grippale il y a plus de 20 ans. En 2014, le groupe a publié les premières structures cristallines du mécanisme complet de polymérase. Cependant, jusqu’à présent, les tentatives de caractérisation structurelle des différentes étapes de la transcription active de la polymérase grippale ont échoué.
« Jusqu’à présent, toutes les études ont examiné la structure du mécanisme de polymérase au repos ; nous ne l’avons jamais observée en train de faire quoi que ce soit », explique Tomas Kouba, chercheur postdoctoral qui, avec Petra Drncová, a effectué une grande partie du travail.
Grâce à la cristallographie aux rayons X et à la cryo-microscopie électronique, toutes deux réalisées sur des équipements de pointe à l’ESRF de Grenoble, l’équipe a pu déterminer, pour la première fois, les structures de résolution atomique de différents états fonctionnels de la polymérase de la grippe, qui transcrivent activement l’ARN génomique en ARNm. Il fournit plus particulièrement la première caractérisation des mouvements de la polymérase au cours du cycle d’addition nucléotidique, chaque nucléotide successif étant ajouté à la chaîne croissante de l’ARNm.
Point cible pour les nouveaux traitements
Malgré son caractère familier, le virus de la grippe – dont certaines souches figurent parmi les dix virus les plus dangereux au monde – est loin d’être bien compris. Selon l’OMS, jusqu’à 500 000 personnes dans le monde meurent chaque année de cette maladie, avec des taux de mortalité potentiellement beaucoup plus élevés lorsqu’une nouvelle souche pandémique de grippe apparaît. La vaccination n’est pas toujours efficace et les traitements contre la grippe sont nécessaires comme option thérapeutique complémentaire.
Étant donné que la polymérase est essentielle à la réplication du virus de la grippe, elle constitue une cible de choix pour le développement de nouveaux médicaments antigrippaux. Ainsi, les résultats obtenus par l’équipe de l’EMBL fournissent de nouvelles informations pour aider à concevoir la prochaine génération de traitements antigrippaux. Les traitements qui empêchent le fonctionnement de la polymérase ont l’avantage de réduire la probabilité que le virus ne mute d’une manière qui rendrait le médicament inutile.
« Nos résultats fournissent les premières images instantanées d’un film qui montrera le cycle complet de transcription de la polymérase grippale, du début à la fin », explique M. Cusack. L’équipe continuera d’utiliser la nouvelle technique performante de la cryo-microscopie électronique pour compléter les étapes manquantes.