Read the latest Issue
New technique for studying living fly larvae
Small changes in a cell’s composition can radically transform its function and drive the development of diseases like diabetes, cancer, or neuronal dysfunction
Scientists led by the European Molecular Biology Laboratory in Heidelberg, the Institute for Genetics of the University of Cologne, the Max Planck Institute for Biology of Ageing, and CECAD and the CMMC in Cologne have developed a method to study processes taking place in the cells of a living fruit fly larva. This technique, published in Nature Protocols on 10 February, provides a simple but effective way to study the functions of organs in living animals.
For decades, scientists have been using the fruit fly Drosophila to understand biological processes. Key biological processes and 60% of fruit fly genes are also seen in humans, having been evolutionarily conserved. The fruit fly is therefore a powerful model organism for studying genetics. Scientists have created many genetic tools and techniques to study molecular processes of development and human disease in the fruit fly.
The challenge
Most previous studies have been carried out in the Drosophila embryo or in adult flies, but the fruit fly larva also offers enormous research potential. Its transparent body, with highly developed functional organs including brain, gut, and muscle, makes the larva an excellent system for observing the dynamics of cellular and molecular processes in living animals.
“The cells in a fruit fly larva are much bigger than in the embryo. You can see all organelles and even the subcellular processes. That’s the beauty of the system,” says Parisa Kakanj, the scientist who led the study in Germany.
However, the larva’s continuous crawling makes live monitoring a challenge, and some cellular processes only reveal their secrets through long-term imaging. Kakanj, a researcher in the groups of Maria Leptin and Linda Partridge, tackled this challenge and developed a method for simple immobilisation of the larvae that allows long-term live imaging and the investigation of cellular events at high resolution.
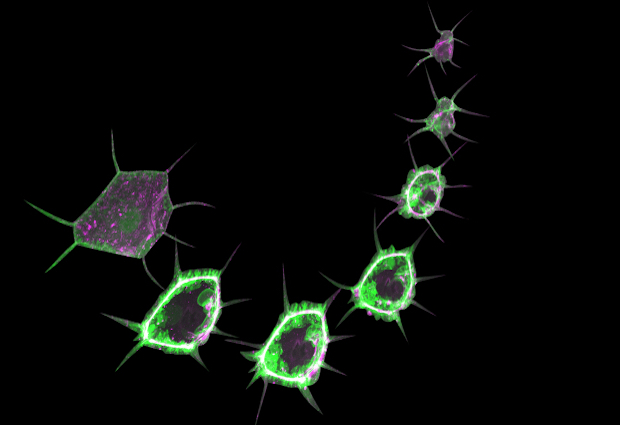
Live imaging of insulin signalling and formation of a contractile cable during wound healing in Drosophila larvae. A sensor for an insulin signal is shown in green, and myosin, a motor protein, in magenta. When the skin is wounded, insulin signalling triggers the formation and contraction of an actomyosin cable around the wound, which constricts the wound and disappears when the wound is closed. VIDEO: Used with permission from Kakanj, P. et al., Nature Protocols (2020).
Simple, fast, and efficient
In the past, scientists have used mechanical methods or anaesthetics to tranquilise fruit fly larvae. Both approaches had undesired side-effects, such as mechanical pressure, limited immobilisation, and high mortality. Further, simultaneous screening of many larvae was impossible.
“In contrast to previous techniques, we developed a simple method for short-term treatment with ether, a classical anaesthetic. This approach allowed undisrupted long-term immobilisation of many larvae in parallel,” explains Parisa Kakanj.

A promising model for drug discovery
To prove the technique’s capabilities, the team investigated wound healing in larvae. They examined the influence of insulin and TOR – crucial signalling molecules for cell survival, growth, and proliferation – on this process. By studying the subcellular dynamics, the scientists created a temporal map of insulin and TOR pathway activity during wound closure. They found that lowering insulin signalling at the wound edge slows down the healing process.
Long-term in vivo imaging, coupled with genetic manipulations, opens the path to many aspects of biology and physiology. “This technique will help many scientists studying neuronal signalling, fat metabolism, or tumour formation, and will provide new opportunities for drug discovery,” says Parisa Kakanj.
Related links
Eine innovative Technik: Visualisierung von Organen und Zellen in lebenden Fliegenlarven
Kleine Abweichungen in der Zusammensetzung einer Zelle können ihre Funktion radikal verändern, und Krankheiten wie Diabetes, Krebs oder neuronale Funktionsstörungen hervorrufen. Wissenschaftler des Europäischen Laboratoriums für Molekularbiologie, des Instituts für Genetik der Universität zu Köln, des Max-Planck-Instituts für Biologie des Alterns, des CECAD und CMMC in Köln haben jetzt eine Methode entwickelt, um die Zellen in der lebenden Fruchtfliegenlarve zu beobachten und zelluläre Prozessen zu verfolgen. Diese Technik, die am 10. Februar in Nature Protocols veröffentlicht wurde, bietet eine einfache, aber effektive Möglichkeit, die Funktionen von Organen in lebenden Tieren zu untersuchen.

Die Fruchtfliege Drosophila gilt als idealer Modelorganismus in der Genforschung. Schlüsselprozesse und 60% der Gene der Fruchtfliege sind identisch zum Menschen. Daher haben Wissenschaftler viele genetische Techniken kreiert, um molekulare Prozesse der Entwicklung und menschliche Krankheiten in der Fliege zu untersuchen.
Die Herausforderung
Die meisten der bisherigen Studien wurden am Embryo oder an der ausgewachsenen Fliege durchgeführt, aber auch die Fruchtfliegenlarve bietet ein enormes Forschungspotenzial. Ihr transparenter Körper mit funktionsfähigen Organen – wie Gehirn, Darm und Muskeln – macht die Larve zu einem hervorragenden Forschungsobjekt, um die Dynamik von Zellen und molekularer Vorgänge in lebenden Tieren zu beobachten.
„Die Zellen in einer Fruchtfliegenlarve sind viel größer als im Embryo. Man kann daher alle Organellen und sogar die kleinsten Prozesse sehen. Das ist das Schöne an diesem System“, sagt Wissenschaftlerin Parisa Kakanj, die die Studie in Deutschland geleitet hat.
Einige molekulare Prozesse und Interaktionen in einer Zelle können nur durch langzeitige Beobachtung entschlüsselt werden. Das kontinuierliche Krabbeln der Larve macht solche Beobachtung jedoch schwierig. Kakanj, eine Forscherin in den Gruppen von Maria Leptin und Linda Partridge, hat sich dieser Herausforderung gestellt und eine Methode zur einfachen Immobilisierung der Larven entwickelt. Diese ermöglicht Langzeit-Live-Beobachtungen von Zellen in hoher Auflösung.
Live-Aufnahme der Insulinsignale und Bildung eines kontraktilen Kabels während der Wundheilung bei Drosophila-Larven. Ein Sensor für Insulinsignale ist grün dargestellt, und Myosin, ein Motorprotein, in Magenta. Wenn die Haut verletzt wird, löst das Insulinsignal die Bildung und Kontraktion eines Actomyosinkabels um die Wunde herum aus. Dieses zieht die Ränder der Wunde zusammen und verschwindet nachdem die Verletzung verschlossen ist. Video: Benutzung mit Genehmigung von Kakanj, P. et al., Nature Protocols (2020).
Einfach, schnell und effizient
In der Vergangenheit haben Wissenschaftler mechanische Methoden oder Betäubungsmittel eingesetzt, um Fruchtfliegenlarven zu immobilisieren. Beide Ansätze hatten jedoch unerwünschte Nebenwirkungen. Zudem war ein gleichzeitige mikroskopische Aufnahme vieler Larven nicht möglich.
„Im Gegensatz zu den bisherigen Techniken haben wir eine einfache Methode zur Kurzzeitbehandlung mit Äther, einem klassischen Anästhetikum, entwickelt. Dieser Ansatz ermöglichte eine problemlose Langzeitimmobilisierung vieler Larven“, erklärt Parisa Kakanj.
Ein vielversprechendes Modell für die Medikamentenentwicklung
Um die Leistungsfähigkeit der Technik zu beweisen, untersuchte das Team die Wundheilung bei Fruchtfliegenlarven. Sie analysierten den Einfluss von Insulin und TOR – einem entscheidenden Signalmolekül für Überleben, Wachstum und Vermehrung – auf diesen Prozess. In ihrer Studie erstellten die Wissenschaftler eine Karte mit dem zeitlichen Ablauf der Insulin- und TOR-Signalweg-Aktivität während der Wundheilung. Sie stellten fest, dass eine Senkung der Insulinsignalaktivität am Wundrand die Heilungsprozesse verlangsamt.
Die langfristige mikroskopische Live-Aufnahme gekoppelt mit genetischen Manipulationen eröffnet den Weg zu neuen Aspekten der Biologie und Physiologie.
„Diese Technik wird vielen Wissenschaftlern bei der Untersuchung der neuronalen Signalübertragung, des Fettstoffwechsels oder der Tumorbildung helfen und neue Möglichkeiten für die Medikamentenentwicklung eröffnen“, sagt Parisa Kakanj.