Objet d’étude : l’insuline
Aperçu
Cette ressource pédagogique vous guidera dans différentes étapes d’apprentissage pour l’exploration de la structure biologique de la molécule de l’insuline – de sa structure primaire jusqu’à sa structure quaternaire.
Voici comment débuter :
- Choisissez le niveau de structure protéinique que vous voulez étudier en sélectionnant l’un des onglets suivants.
- Étudiez les détails structurels de l’insuline et effectuez les exercices proposés.
- Essayez par la suite de répondre aux questions du Test de connaissances sur l’Insuline.
- La Fiche de travail sur l’Insuline peut être imprimée et utilisée pour tester vos connaissances sur la biologie structurelle de l’insuline. Colorez les structures afin de les explorer en 3D!
Info
L’insuline est synthétisée au départ sous la forme de préproinsuline, une chaîne polypeptidique à 110 acides aminés qui contient des séquences additionnelles :
- Une “pré” séquence N-terminale (un peptide signal formé de 24 acides aminés), qui permet la production de la protéine.
- Une séquence “pro” centrale (le peptide C formé de 35 acides aminés), qui détermine le repliement adéquat de la protéine.
Après la traduction de la préproprotéine dans le réticulum endoplasmique, une enzyme coupe les 24 acides aminés de la section N-Terminale, qui vont se dissocier de la proinsuline, laquelle se repliera et permettra la formation de liaisons disulfures entre les résidus de cystéine.
À cette étape du processus, la protéine passe par l’appareil de Golgi, où le peptide C sera retiré, pour ainsi former la version définitive de l’insuline qui sera stockée dans les vésicules de l’appareil de Golgi.
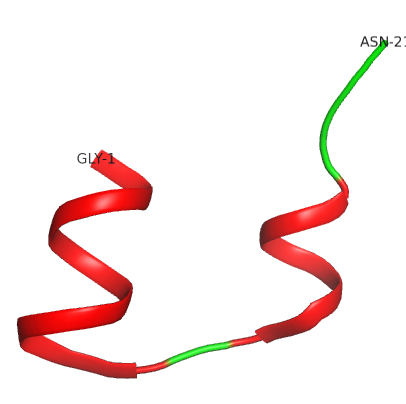
La protéine de l’insuline mature est composée de deux chaînes polypeptidiques (chaînes A et B) La chaîne A est formée de 21 acides aminés et la chaîne B comprend 30 acides aminés.
Primary
La protéine de l’insuline mature consiste en deux chaînes de polypeptides (chaînes A et B). La chaîne A est composée de 21 acides aminés alors que la chaîne B est formée de 30 acides aminés (vous pourrez trouver leurs séquences ci-dessous).
Tâche
Dans les activités suivantes, comparez les chaînes A (et les chaînes B) des insulines humaines et porcines en alignant leurs séquences d’acides aminés. Y a-t-il des différences dans leur séquence d’acides aminés respective ?
- Copiez les deux séquences d’acides aminés ci-dessous, soit celle de l’insuline humaine et celle de l’insuline porcine. Sélectionnez et copiez le bloc complet des séquences débutant par >sp pour les chaînes A (étape 1) puis pour les chaînes B (étape 2).
- Collez les séquences dans la zone de recherche MUSCLE (raccourci-clavier Ctrl. + V).
- Dans la section “ÉTAPE 2”, assurez-vous que le “Format de sortie” correspond à “ClustalW”.
- Cliquez sur le gros bouton “Envoyer” et votre alignement sera traité.
- Vous pourrez voir le résultat en quelques secondes. Observez l’alignement et répondez aux questions du test.
Note : pour arriver à envoyer le deuxième ensemble de séquences, vous devrez peut-être actualiser votre page ce qui permettra de vider la zone de recherche MUSCLE.
Étape 1 – Comparez les chaînes A :
>sp|P01308|90-110, chaîne A Insuline, Humaine
GIVEQCCTSICSLYQLENYCN
>sp|P01315|88-108, chaîne A Insuline, Porcine
GIVEQCCTSICSLYQLENYCN
Étape 2 – Comparez les chaînes B :
>sp|P01308|25-54, Chaîne B Insuline, Humaine
FVNQHLCGSHLVEALYLVCGERGFFYTPKT
>sp|P01315|25-54, chaîne B Insuline, Porcine
FVNQHLCGSHLVEALYLVCGERGFFYTPKA
Sec.
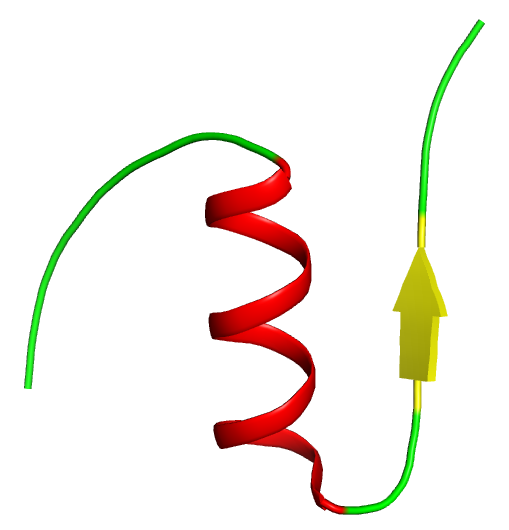
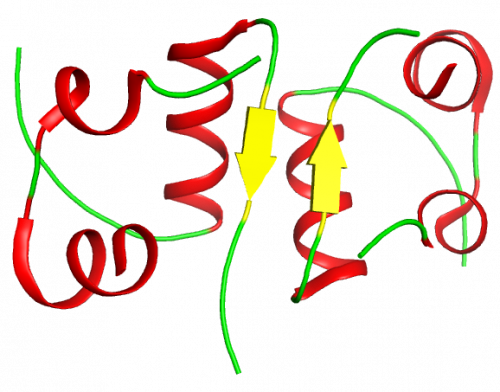
La chaîne B possède une section majeure d’hélice-a et une région avec un feuillet bêta. Celui-ci se replie avec précision autour de la chaîne A (voir la structure tertiaire).
Tert.
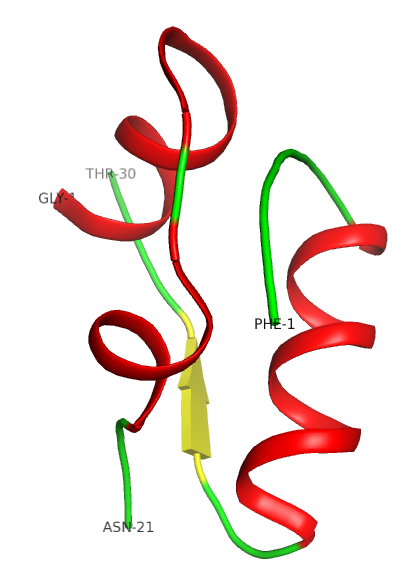
La structure tertiaire est stabilisée par des ponts disulfures (voir la fiche de travail sur l’insuline). La partie externe de la protéine est polaire, alors que sa partie interne est principalement hydrophobe.
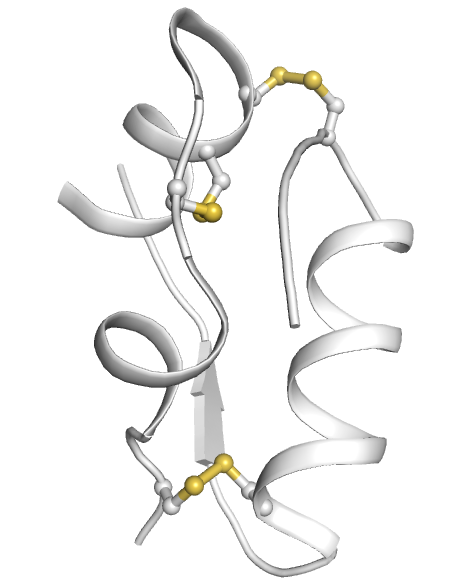
L’insuline est composée de deux chaînes de polypeptides (chaînes A et B), qui sont unies l’une à l’autre par deux ponts disulfures; un troisième pont disulfure est situé à l’intérieur de la chaîne A.
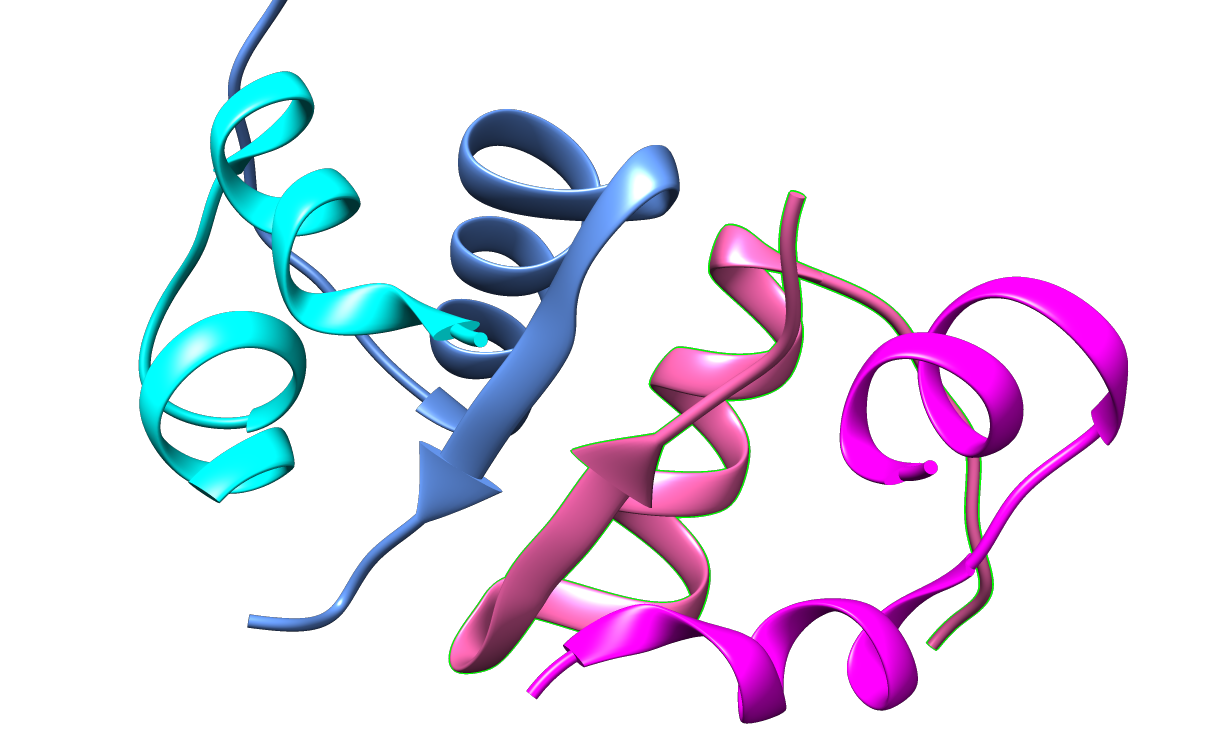
Quat.
En ce qui concerne la structure quaternaire, l’insuline a tendance à former des dimères lorsqu’elle est placée en solution, ce qui permet la formation de liaisons hydrogènes entre les extrémités C-terminales de la chaîne B.
Fiche de travail
Commencez par télécharger la Fiche de travail sur l’insuline et imprimez-la.
Tâches
- Utilisez vos lunettes stéréo pour explorer la structure 3D de la protéine (en haut à gauche).
- Colorez la chaîne A de l’insuline selon le schéma de couleur ci-dessous.
- Colorez la chaîne B de l’insuline selon le schéma de couleur ci-dessous.
- Colorez les structures suivantes dans la protéine de l’insuline sur la droite :
- hélices alpha
- feuillets bêta
- liaisons disulfures
Schéma de coloration:
- hélice alpha – rouge
- feuillet bêta – jaune
- parties non structurées de la protéine – vert
- Liaisons disulfures – orange
- L’extrémité N-terminale de la protéine – bleu
- L’extrémité C-terminale de la protéine – violet
Associées
Effectuez le TEST de connaissances sur l’insuline pour vérifier votre niveau de connaissances de cette molécule fascinante.
Matériels supplémentaires
Regardez la présentation EMBL Insight Lecture 2013 “From Code to Function – Observation de la synthèse des protéines au microscope électronique“.
Christiane Schaffitzel and her team study the function and three-dimensional structure of ribosomes using a combination of molecular biology, biochemistry and cryo-electron microscopy. In her talk, Christiane gives an overview of the steps involved in protein synthesis and the role ribosomes play in the process. She then illustrates how her research group uses cryo-electron microscopy to study the structures of these fascinating molecules. Christiane’s central research questions are: what we can learn from the make up of these fascinating molecules and how are synthesised proteins targeted to their destinations?
Topic area: Structural & Computational biology
Age group: 16-19
Share:
 English
English Deutsch
Deutsch Italiano
Italiano