Focus on: Insulin
Übersicht
Diese Lernaktivität führt Sie durch verschiedene Schritte, um die molekulare Struktur des Insulin Proteins zu erkunden – von der Primär- bis zur Quartär-Struktur.
Hier geht’s los:
- Wählen Sie die strukturelle Organisationsebene des Proteins, über die Sie mehr erfahren möchten. Sie können dies über die Reiter weiter unten tun.
- Informieren Sie sich über die strukturellen Eigenschaften des Insulinmoleküls und gehen Sie die Übungen durch.
- Versuchen Sie die Fragen im Insulin Quiz zu beantworten.
- Das Insulin Arbeitsblatt steht zum Download und Ausdruck bereit. Sie können es benutzen, um ihr Wissen über die Strukturbiologie des Insulins zu überprüfen. Färben Sie selbst die Strukturelemente ein und schauen Sie sich das Molekül in 3D an!
Info
Insulin wird zunächst als Präproinsulin synthetisiert. Es handelt sich dabei um ein 110 Aminosäuren umfassendes Polypeptid, welches zusätzliche Sequenzbestandteile (Aminosäuren) enthält.
- Eine “prä” Amino-terminale Sequenz (Signalpeptid bestehend aus 24 Aminosäuren), welches die Sekretion des Proteins möglich macht.
- Eine zentrale “pro”-Sequenz (das C-Peptid bestehend aus 35 Aminosäuren), welches die korrekte Faltung des Proteins bestimmt.
Nach der Translation des Präproinsulins im Endoplasmatischen Retikulum schneidet ein Enzym die 24 Aminosäuren am Aminoterminus des Proteins ab. Das entstandene Proinsulin faltet sich und erlaubt dadurch die Ausbildung von Disulfidbrücken zwischen Cystein-Aminosäuren im Protein.
In diesem Stadium wird das Protein in den Golgi-Apparat geschleust, wo das C-Peptid entfernt wird. Das “reife” Insulin wird dann in den Golgi-Vesikeln gespeichert.
Das reife Insulin besteht aus zwei Polypeptidketten (A- und B-Ketten). Die A-Kette wird von 21 Aminosäuren gebildet und die B-Kette von 30 Aminosäuren.
Primär
Das reife Insulin Protein besteht aus zwei Polypeptidketten (A- und B-Ketten). Die A-Kette wird von 21 Aminosäuren gebildet und die B-Kette von 30 Aminosäuren.
Aufgabe:
Vergleichen Sie die A-Ketten (und die B-Ketten) des humanen und des Schweine-Insulins. In der folgenden Aktivität werden Sie dazu die Aminosäuresequenzen “alignieren”. Gibt es Unterschiede in den Aminosäuresequenzen?
- Kopieren Sie die zwei Aminosäuresequenzen des Insulins vom Menschen und vom Schwein, die Sie weiter unten finden. Markieren und kopieren Sie den ganzen Textblock, der mit >sp für die A-Ketten (Vergleich 1) beginnt. Verfahren Sie dann gleich für die B-Ketten (Vergleich 2).
- Fügen Sie die Sequenzen in die Suchmaske von MUSCLE ein (Shortcut Strg.+v).
- Im “STEP 2″ benannten Abschnitt sollten Sie darauf achten, dass als Ausgabeformat (“Output Format”) “ClustalW” eingestellt ist.
- Klicken Sie auf den großen “Submit” Knopf, um Ihren Sequenzvergleich zu starten.
- Nach einigen Sekunden werden Sie die Ergebnisse sehen. Schauen Sie sich den Sequenzvergleich (Alignment) an und beantworten Sie die Fragen im Quiz.
Info: Um den zweiten Sequenzvergleich abschicken zu können, sollten Sie die Webseite zuerst aktualisieren. Die MUSCLE-Suchmaske wird dadurch zurückgesetzt.
Vergleich 1 – Vergleich der Insulin A-Ketten:
>sp|P01308|90-110, Insulin A-Kette, Mensch
GIVEQCCTSICSLYQLENYCN
>sp|P01315|88-108, Insulin A-Kette, Schwein
GIVEQCCTSICSLYQLENYCN
Vergleich 2 – Vergleich der Insulin B-Ketten:
>sp|P01308|25-54, Insulin B-Kette, Mensch
FVNQHLCGSHLVEALYLVCGERGFFYTPKT
>sp|P01315|25-54, Insulin B-Kette, Schwein
FVNQHLCGSHLVEALYLVCGERGFFYTPKA
Sekundär
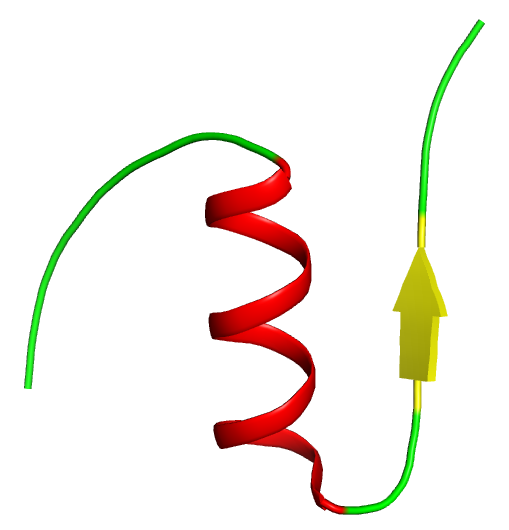
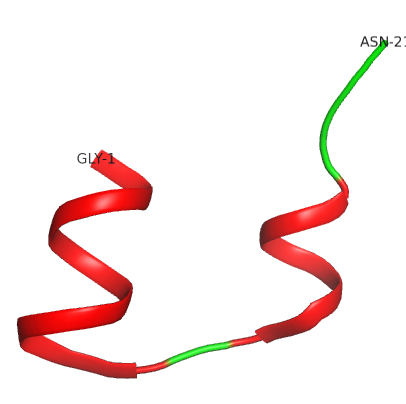
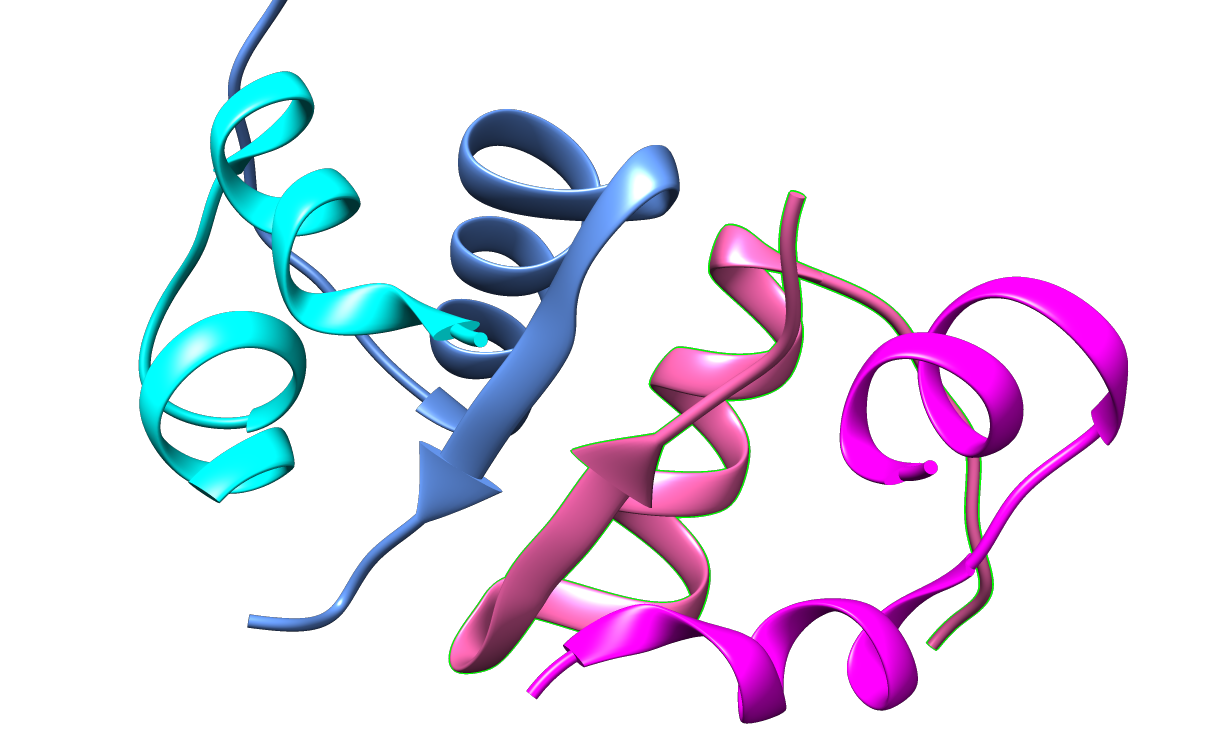
Die B-Kette besteht aus einem alpha-helikalen Bereich und einer beta-Faltblatt Region. Diese faltet sich um die A-Kette herum (zu sehen in der Tertiärstruktur).
Tertiär
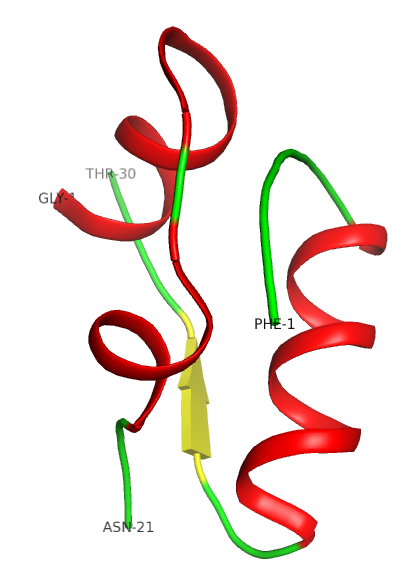
Die Tertiärstruktur wird durch Disulfidbrücken stabilisiert (siehe Insulin Arbeitsblatt). Der nach aussen gerichtete Teil des Proteins ist polar, während der interne Teil sich größtenteils hydrophob verhält.
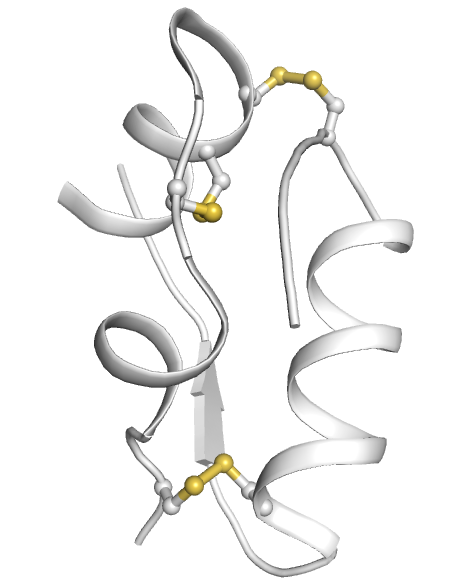
Insulin besteht aus zwei Polypeptidketten (A- und B-Ketten), die durch 2 Disulfidbrücken zusammengehalten werden. Eine dritte Disulfidbrücke befindet sich innerhalb der A-Kette.
Quartär
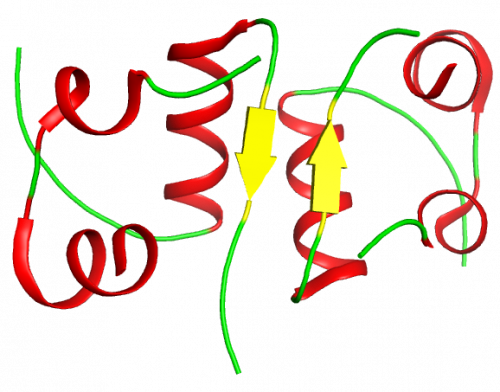
Schaut man sich die Quartärstruktur des Insulins an, beobachtet man, dass Insulin in Lösung meist als Dimer vorliegt. Dies wird ermöglicht durch die Ausbildung von Wasserstoffbrücken zwischen den C-terminalen Enden der B-Ketten.
Arbeitsblatt
Laden Sie sich zuerst das Insulin Arbeitsblatt herunter und drucken Sie es aus:
Aufgaben
- Benutzen Sie eine Stereobrille um die Proteinstruktur des Insulins in 3D zu sehen (oben links).

- Färben Sie die Insulin A-Kette an. Benutzen Sie dabei den Farbcode, der unten angegeben ist.
- Färben Sie die Insulin B-Kette an (Farbcode unten).
- Malen Sie die folgenden Strukturelemente im Insulin Protein auf der rechten Seite an:
- Alpha-Helices
- Beta-Faltblätter
- Disulfidbrücken
Farbcode:
- Alpha-Helix – Rot
- Beta-Faltblatt – Gelb
- Unstrukturierte Teile des Proteins – Grün
- Disulfidbrücken – Orange
- N-Terminus des Proteins – Blau
- C-Terminus des Proteins – Violett
Quiz
Machen Sie das Insulin Quiz und überprüfen Sie ihr Wissen über dieses Molekül.
Zusatzmaterial
Schauen Sie sich die EMBL Insight Lecture 2013 “From Code to Function – Observing Protein Synthesis Through the Electron Microscope” an.
Der Vortrag ist in Englisch verfügbar.
Christiane Schaffitzel and her team study the function and three-dimensional structure of ribosomes using a combination of molecular biology, biochemistry and cryo-electron microscopy. In her talk, Christiane gives an overview of the steps involved in protein synthesis and the role ribosomes play in the process. She then illustrates how her research group uses cryo-electron microscopy to study the structures of these fascinating molecules. Christiane’s central research questions are: what we can learn from the make up of these fascinating molecules and how are synthesised proteins targeted to their destinations?
Topic area: Structural & Computational biology
Age group: 16-19
Share:
 English
English Français
Français Italiano
Italiano